« Tachycardies ventriculaires sur séquelle d'infarctus » : différence entre les versions
Aucun résumé des modifications |
|||
| Ligne 36 : | Ligne 36 : | ||
== '''Prise en charge''' == | == '''Prise en charge''' == | ||
La prise en charge d'une tachycardie ventriculaire sur une séquelle d'infarctus se distingue en 2 phases : aigue et chronique | |||
A la phase aigue : | |||
== '''Bibliographie''' == | == '''Bibliographie''' == | ||
Version du 2 juillet 2023 à 12:26
Généralité
Les arythmies ventriculaires font partie des complications les plus redoutées de la maladie coronaire.
La tachycardie ventriculaire polymorphe ou la fibrillation ventriculaire se développe le plus fréquemment à la phase aiguë de l’infarctus. Alors que l’arythmie liée aux cicatrices (séquelles d’infarctus) à distance d’épisode aiguë, se manifeste généralement par une tachycardie ventriculaire monomorphe non soutenue ou soutenue.
Mécanisme
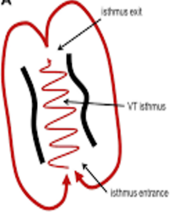
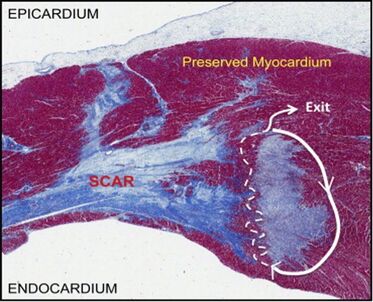
Le mécanisme de la tachycardie ventriculaire monomorphe sur séquelle d’infarctus est dans la plupart des cas le circuit réentrant. Le circuit réentrant se constitue d'un site d'entrée, d'un isthme protégé et d'un site de sortie qui active les ventricules.
La réentrée se produit en général sur un obstacle anatomique. Deux conditions sont nécessaires à la réentrée sont : un bloc de conduction unidirectionnel ( c’est-à-dire une propagation dans une direction donnée alors que la conduction dans la direction opposée est bloquée) et une zone de conduction suffisamment lente (le temps mis pour parcourir le circuit doit être supérieur à la période réfractaire des fibres où se produit la réentrée).
Au cours des jours, des semaines et des mois suivants d’infarctus, les myocytes nécrotiques sont éliminés par les macrophages et remplacés par des tissus fibreux, ce qui crée des zones de fibroses (zone de scar). Le zone de scar est considéré comme un obstacle anatomique pour le circuit rentrée. La hétérogénéité du processus d'infarctus aboutit aux ilots de cellules myocardiques survivantes au sein de ces zones de fibrose. La fibrose au sein de ces îlots entraine un ralentissement de la conduction à travers ces myocytes vivantes, ce qui crée un zone de conduction lente favorise lente . Ces caractéristiques peuvent soutenir des circuits de réentrée stables, conduisant à une TV monomorphe, lorsqu'un déclencheur approprié se produit (une extrasystole ventriculaire…)
Diagnostic d'électrocardiogramme
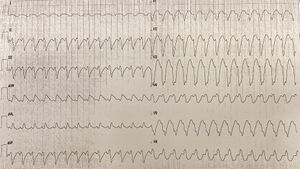
La tachycardie ventriculaire sur séquelle d’infarctus se manifeste sur ECG par une tachycardie ventriculaire monomorphe (rythme régulier rapide souvent aux alentours de 180 bpm, le complexe d’QRS élargi supérieur à 120 ms avec une seule morphologie).
La morphologie du QRS sur l’ECG de surface dépend principalement du site de sortie endocardique du circuit de réentrée (le site à partir duquel le myocarde normal est rapidement activé).
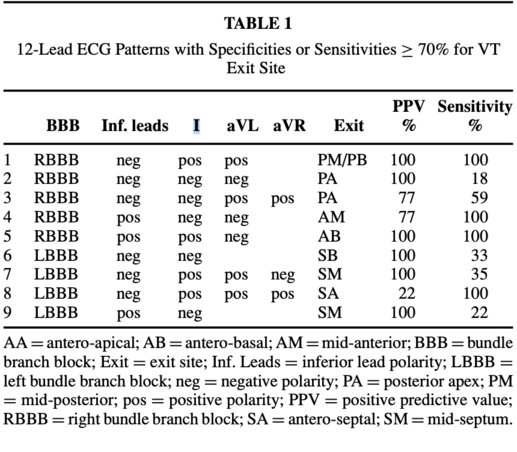
Segal et al ont proposé un algorithme pour déterminer le site de sortie endocardique du circuit de tachycardie ventriculaire. Cet algorithme est basé sur:
- Morphologie de QRS en V1 pour déterminer la paterne de bloc de branche gauche (aspect QS, rS ou qrS) ou droite (aspect d’onde R mono ou bi ou triphasique ou aspect qR)
- Polarité de QRS en inférieur (DII, DIII et avF)
- Polarité de QRS en D1, aVL
- Polarité de QRS en aVR
Prise en charge
La prise en charge d'une tachycardie ventriculaire sur une séquelle d'infarctus se distingue en 2 phases : aigue et chronique
A la phase aigue :
Bibliographie
- ↑ Pace Mapping to Localize the Critical Isthmus of Ventricular Tachycardia. de Chillou C, Sellal JM, Magnin-Poull I.Card Electrophysiol Clin. 2017 Mar;9(1):71-80. doi: 10.1016/j.ccep.2016.10.005. Epub 2016 Dec 28.
- ↑ Tung R, Boyle NG, Shivkumar K. Circulation. 2011; 123(20):2284–2288.
- ↑ A novel algorithm for determining endocardial VT exit site from 12-lead surface ECG characteristics in human, infarct-related ventricular tachycardia Oliver R Segal 1, Anthony W C Chow, Tom Wong, Nicola Trevisi, Martin D Lowe, D Wyn Davies, Paolo Della Bella, Douglas L Packer, Nicholas S Peters