TV polymorphe catécholergique
Introduction :
La TV polymorphe catécholergique a été décrite pour la première fois en 1975 par Reid et al. [14] en rapportant le cas d’une enfant de 6 ans ayant présenté une tachycardie ventriculaire bidirectionnelle déclenchée par l’effort avec un bilan ne retrouvant pas de cardiopathie sous-jacente. Puis, Leenhardt et al. en 1995 [15] ont rapporté une série de cas familiaux où le terme de TV polymorphe catécholergique a été décrit. La prévalence de cette pathologie est estimée à 1/ 10 000 eu Europe [16]. L’âge de découverte est entre 7 et 9 ans, par des syncopes à l’effort ou des émotions. Environ un tiers des patients présenteront des symptômes avant l’âge de 10 ans et un tiers des patients ont une histoire familiale (Ackerman M.J et al., 2011 [17] ). L’ECG de repos est le plus souvent normal, avec un intervalle QT non allongé. On peut néanmoins retrouver une bradycardie sinusale et des ondes U amples. Par ailleurs, l’imagerie cardiaque est également sans anomalie.
Le diagnostic se fait donc lors d’une épreuve d’effort ou d’un Holter ECG avec déclenchement de TV bidirectionnelle (figure 6). L’existence concomitante de trouble du rythme supra-ventriculaire est fréquente. Il existe souvent un retard diagnostic devant des syncopes ou lipothymies attribuées à une origine vasovagale ou neurologique.
Diagnostic :
On peut porter le diagnostic de TVPC lorsque : - Mise en évidence d’une TV bidirectionnelle ou polymorphe, déclenchant par l’effort ou l’émotion, avec un cœur structurellement sain et avec un ECG de repos normal. - Ou, chez les patients porteurs d’un variant pathogène hétérozygote sur RYR2 ou CALM1, ou biallélique sur CASQ2 ,sur le gène de la triadine (TRDN) et plus récemment sur le gène TECRL.
Physiopathologie :
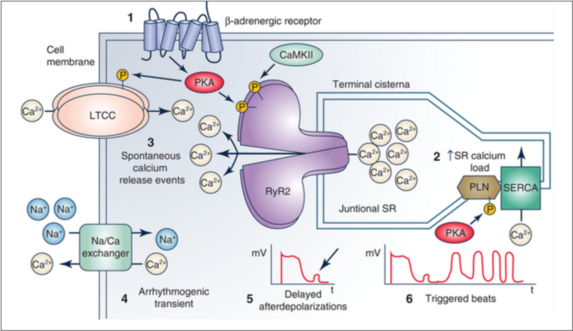
1 : Les catécholamines libérées lors d’un effort activent les récepteurs b conduisant à une recharge calcique du réticulum sarcoplasmique permettant une contraction myocardique augmentée afin de pouvoir réagir au stress.
2 : Augmentation de la charge calcique dans le RS.
3 : En cas de TVPC, on observe une ouverture spontanée des canaux RyR2 en diastole non régulée.
4 : L’augmentation du Ca2+ cytosolique entraine l’activation du canal échangeur Na+/Ca+ générant un courant entrant arythmogène.
5 : Ce courant entraine une dépolarisation membranaire nommée « post-dépolarisation tardive »
6 : Ces post-dépolarisations sont connues pour pouvoir entrainer des troubles du rythme ventriculaire.
Pronostic et prise en charge :
Le pronostic des patients atteints de TV polymorphe catécholergique est péjoratif sans traitement avec une mortalité pouvant atteindre 50% avant l’âge de 40 ans. Les facteurs de risque de survenue de trouble du rythme sont le jeune âge au moment du diagnostic et l’absence de traitement bétabloquant [18]. Le traitement repose sur des contre-indications à la pratique sportive et les bétabloquants et notamment le Nadolol. La prévention par implantation d’un défibrillateur automatique implantable reste controversée devant la possibilité d’induire un stress adrénergique supplémentaire et d’alimenter les troubles du rythme ventriculaire.
Bases Génétiques :
Les bases génétiques de la TV polymorphe catécholergique reposent sur la mise en évidence d’un locus associé à une forme dominante de TV polymorphe catécholergique en 1999 en position 1q42-43 (Swan et al. 1999 [19]). Puis, en 2001, deux équipes publient l’implication du gène RYR2 (Laitinen et al. 2001[20] ; Priori et al. 2001 [21]). Enfin, une forme autosomique récessive de la TV polymorphe catécholergique est démontrée avec le gène CASQ2 sur le chromosome 1 (Lahat et al. 2001 [10]). Le mode de transmission des TV polymorphe catécholergique liées à CASQ2 était reconnu comme autosomique récessif (Table 1), assez récemment des formes dominantes ont également été décrites dans la littérature.
Il a été décrit 7 différents gènes responsables de 60 à 75% des TVPC : le plus fréquemment mis en évidence est RyR2, puis CASQ2 et enfin des gènes nettement plus rares tels que le gène codant pour la triadine (TRDN), les gènes codant pour les calmodulines (CALM 1, CALM 2, CALM 3) et le gène TECRL découvert plus récemment (Devalla et al. 2016 [22]) (table 1). La pénétrance des variants RYR2 est estimée à 80% tandis que la pénétrance des variants pathogènes des gènes CASQ2, TRDN et CALM1 serait de 100%.