TV polymorphe catécholergique
Introduction
La TV polymorphe catécholergique a été décrite pour la première fois en 1975 par Reid et al. [1] en rapportant le cas d’une enfant de 6 ans ayant présenté une tachycardie ventriculaire bidirectionnelle déclenchée par l’effort avec un bilan ne retrouvant pas de cardiopathie sous-jacente. Puis, Leenhardt et al. en 1995 [2] ont rapporté une série de cas familiaux où le terme de TV polymorphe catécholergique a été décrit. La prévalence de cette pathologie est estimée à 1/ 10 000 eu Europe[3]. L’âge de découverte est entre 7 et 9 ans, par des syncopes à l’effort ou des émotions. Environ un tiers des patients présenteront des symptômes avant l’âge de 10 ans et un tiers des patients ont une histoire familiale [4]. L’ECG de repos est le plus souvent normal, avec un intervalle QT non allongé. On peut néanmoins retrouver une bradycardie sinusale et des ondes U amples. Par ailleurs, l’imagerie cardiaque est également sans anomalie.
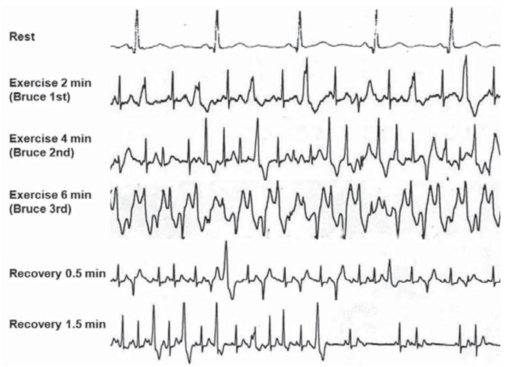
Le diagnostic se fait donc lors d’une épreuve d’effort ou d’un Holter ECG avec déclenchement de TV bidirectionnelle (figure 1). L’existence concomitante de trouble du rythme supra-ventriculaire est fréquente. Il existe souvent un retard diagnostic devant des syncopes ou lipothymies attribuées à une origine vasovagale ou neurologique.
Diagnostic
On peut porter le diagnostic de TV polymorphe catécholergique lorsque :
- Mise en évidence d’une TV bidirectionnelle ou polymorphe, déclenchant par l’effort ou l’émotion, avec un cœur structurellement sain et avec un ECG de repos normal.
- Ou, chez les patients porteurs d’un variant pathogène hétérozygote sur RYR2 ou CALM1, ou biallélique sur CASQ2 ,sur le gène de la triadine (TRDN) et plus récemment sur le gène TECRL.
Figure 1 : ECG représentant une tachycardie ventriculaire bidirectionnelle lors d'une épreuve d'effort, d'après [5]
Physiopathologie
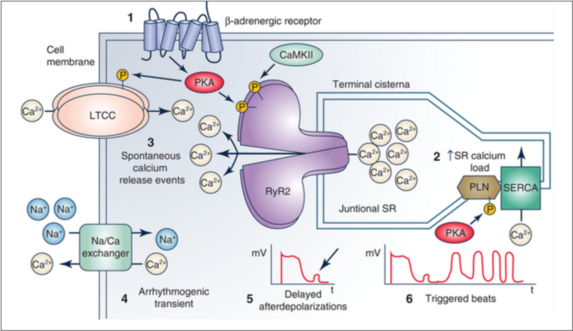
1: Les catécholamines libérées lors d’un effort activent les récepteurs bêta conduisant à une recharge calcique du réticulum sarcoplasmique permettant une contraction myocardique augmentée afin de pouvoir réagir au stress.
2 : Augmentation de la charge calcique dans le réticulum sarcoplasmique
3 : En cas de TVPC, on observe une ouverture spontanée des canaux RyR2 en diastole non régulée.
4 : L’augmentation du Ca2+ cytosolique entraine l’activation du canal échangeur Na+/Ca+ générant un courant entrant arythmogène.
5 : Ce courant entraine une dépolarisation membranaire nommée «post-dépolarisation tardive»
6 : Ces post-dépolarisations sont connues pour pouvoir entrainer des troubles du rythme ventriculaire.
Pronostic et prise en charge
Le pronostic des patients atteints de TV polymorphe catécholergique est péjoratif sans traitement avec une mortalité pouvant atteindre 50% avant l’âge de 40 ans. Les facteurs de risque de survenue de trouble du rythme sont le jeune âge au moment du diagnostic et l’absence de traitement bêtabloquant [7]. Le traitement repose sur des contre-indications à la pratique sportive et les bétabloquants et notamment le Nadolol. La prévention par implantation d’un défibrillateur automatique implantable reste controversée devant la possibilité d’induire un stress adrénergique supplémentaire et d’alimenter les troubles du rythme ventriculaire.
Bases génétiques
Les bases génétiques de la TV polymorphe catécholergique reposent sur la mise en évidence d’un locus associé à une forme dominante de TV polymorphe catécholergique en 1999 en position 1q42-43 [8]. Puis, en 2001, deux équipes publient l’implication du gène RYR2 [9][10]. Enfin, une forme autosomique récessive de la TV polymorphe catécholergique est démontrée avec le gène CASQ2 sur le chromosome 1[11]. Le mode de transmission des TV polymorphe catécholergique liées à CASQ2 était reconnu comme autosomique récessif, assez récemment des formes dominantes ont également été décrites dans la littérature.
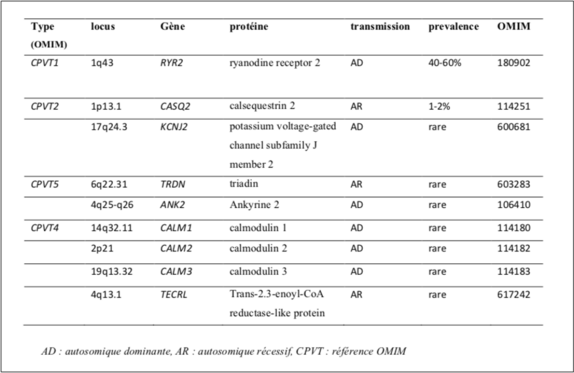
Il a été décrit 7 différents gènes responsables de 60 à 75% des TVPC: le plus fréquemment mis en évidence est RyR2, puis CASQ2 et enfin des gènes nettement plus rares tels que le gène codant pour la triadine (TRDN), les gènes codant pour les calmodulines (CALM 1, CALM 2, CALM 3) et le gène TECRL découvert plus récemment [12]. La pénétrance des variants RYR2 est estimée à 80% tandis que la pénétrance des variants pathogènes des gènes CASQ2, TRDN et CALM1 serait de 100%.
Tableau 1: Gènes impliqués dans TVPC d’après l’Association des Praticiens des Génétique Moléculaire (ANPGM).
Références
- ↑ Reid DS, Tynan M, Braidwood L, Fitzgerald GR. Bidirectional tachycardia in a child. A study using His bundle electrography. Heart. 1975;37:339–44.
- ↑ Leenhardt A, Lucet V, Denjoy I, Grau F, Ngoc DD, Coumel P. Catecholaminergic polymorphic ventricular tachycardia in children. A 7-year follow-up of 21 patients. Circulation. 1995;91:1512–9.
- ↑ Priori SG, Wilde AA, Horie M, Cho Y, Behr ER, Berul C, et al. HRS/EHRA/APHRS expert consensus statement on the diagnosis and management of patients with inherited primary arrhythmia syndromes: document endorsed by HRS, EHRA, and APHRS in May 2013 and by ACCF, AHA, PACES, and AEPC in June 2013. Heart Rhythm. 2013;10:1932–63.
- ↑ Ackerman MJ, Priori SG, Willems S, Berul C, Brugada R, Calkins H, et al. HRS/EHRA expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies this document was developed as a partnership between the Heart Rhythm Society (HRS) and the European Heart Rhythm Association (EHRA). Heart Rhythm. 2011;8:1308–39.
- ↑ Liu, N., Colombi, B., Raytcheva-Buono, E.V. et al. Catecholaminergic Polymorphic Ventricular Tachycardia. Herz 32, 212–217 (2007). https://doi.org/10.1007/s00059-007-2975-2
- ↑ Wleklinski MJ, Kannankeril PJ, Knollmann BC. Molecular and tissue mechanisms of catecholaminergic polymorphic ventricular tachycardia. J Physiol. 2020;598:2817–34.
- ↑ Hayashi M, Denjoy I, Extramiana F, Maltret A, Buisson NR, Lupoglazoff J-M, et al. Incidence and Risk Factors of Arrhythmic Events in Catecholaminergic Polymorphic Ventricular Tachycardia. Circulation. 2009;119:2426–34.
- ↑ Swan H, Piippo K, Viitasalo M, Heikkilä P, Paavonen T, Kainulainen K, et al. Arrhythmic disorder mapped to chromosome 1q42-q43 causes malignant polymorphic ventricular tachycardia in structurally normal hearts. J Am Coll Cardiol. 1999;34:2035–42.
- ↑ Laitinen PJ, Brown KM, Piippo K, Swan H, Devaney JM, Brahmbhatt B, et al. Mutations of the cardiac ryanodine receptor (RyR2) gene in familial polymorphic ventricular tachycardia. Circulation. 2001;103:485–90.
- ↑ Priori SG, Napolitano C, Tiso N, Memmi M, Vignati G, Bloise R, et al. Mutations in the cardiac ryanodine receptor gene (hRyR2) underlie catecholaminergic polymorphic ventricular tachycardia. Circulation. 2001;103:196–200.
- ↑ Lahat H, Pras E, Olender T, Avidan N, Ben-Asher E, Man O, et al. A missense mutation in a highly conserved region of CASQ2 is associated with autosomal recessive catecholamine-induced polymorphic ventricular tachycardia in Bedouin families from Israel. Am J Hum Genet. 2001;69:1378–84.
- ↑ Devalla HD, Gélinas R, Aburawi EH, Beqqali A, Goyette P, Freund C, et al. TECRL, a new life-threatening inherited arrhythmia gene associated with overlapping clinical features of both LQTS and CPVT. EMBO Mol Med. 2016;8:1390–408.