Syndrome de Brugada
Introduction
Le syndrome de Brugada est une maladie rythmique héréditaire à transmission autosomique dominante et à pénétrance variable.
Il a été décrit dès 1992 par Brugada et al. à partir d'une cohorte de 8 patients aux antécédents d'arrêt cardiaque, sans cardiopathie structurelle sous-jacente et dont l'ECG montrait un sus-décalage du segment ST dans les dérivations précordiales V1 et V2 [1].
Le principal gène impliqué est le gène SCN5A, codant pour la sous-unité NaV1.5 du canal sodique cardiaque INa. Néanmoins, une mutation de SCN5A est retrouvée chez moins de 30% des sujets [2].
Il est a noté que les mutations de SCN5A ont un effet pléïotrope et sont également associées entre autre au syndrome du QT long ou bien à des troubles de la conduction intraventriculaire [3].
Le fait d'être porteur d'un syndrome de Brugada augmente le risque de mort subite par trouble du rythme ventriculaire en comparaison à la population générale.
Définition
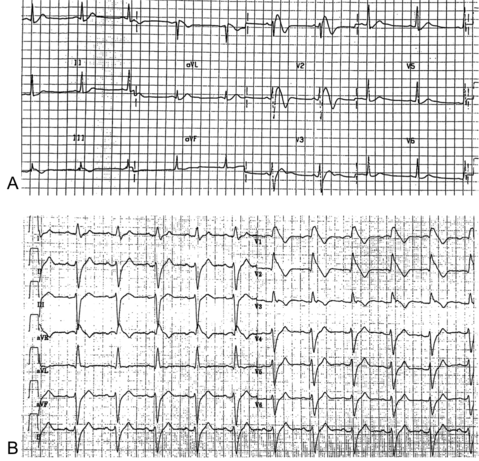
L'électrocardiogramme est la pierre angulaire du diagnostic du syndrome de Brugada. Néanmoins, celui-ci est rendu difficile par le fait que l'aspect dit de Brugada type 1 qui amène à poser le diagnostic peut être intermittent pour un patient donné et modulé par de nombreux facteurs endogène et exogènes.
Recommandations
Le syndrome de Brugada se définit donc dans par les recommandations HRS/EHRA/APHRS 2013 [2] et ESC 2015 [4] par :
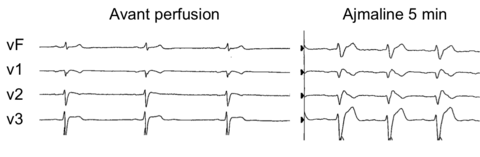
La présence d’un sus-décalage du segment ST ≥ 2 mm suivi d'une onde T négative (ie aspect dit de type 1) dans au moins une dérivation précordiale droite (V1 ou V2), positionnée aux 2e, 3e ou 4e espace intectostal ;
- soit spontanément,
- soit démaqué par un test de provocation par administration d'un bloqueur des canaux sodiques (anti-arythmique de classe I : Ajmaline, Flécaïne, Procaïnamide, Pilsicaïnide). Il est acteullement suggéré de préférer le test à l'Ajamaline dont les performances diagnostiques sont meilleures [5].
Les aspect Brugada dits de type 2 et de type 3 n'ont actuellement plus de pertinence clinique en l'absence d'association à un type 1 induit.
Score de Shangai
Du fait d'un risque de faux positifs au test de provocation, le Score de Shanghai a secondairement été proposé afin de limiter ce risque de surdiagnostic [6] [7]. Il se base sur l'aspect ECG, les antécédents personnels et familiaux du patient et tient également compte des résultats du test génétique. L'application du score est sous-tendue par la présence d'un aspect électrique de type I :
- Critères ECG : Aspect de type 1 OBLIGATOIRE
- soit spontanément (3,5 points),
- soit en contexte d'hyperthermie (3 points),
- soit lors d'un test de provocation (2 points)
- Antécédents personnels
- Un arrêt cardiaque ou la documentation d'une fibrillation ventriculaire ou tachycardie ventriculaire polymorphe (3 points)
- Une respiration agonique nocturne (2 points)
- Une syncope suggestive d'origine rythmique (2 points) ou d'étiologie/mécanisme indéterminé (1 point)
- Un antécédent de fibrillation atriale ou flutter atrial avant 30 ans sans autre étiologie évidente (1 point)
- Antécédents familiaux chez un apparenté au 1er ou 2e degré
- Porteur d'un syndrome de Brugada (2 points)
- Ayant présenté une mort subite en contexte évocateur de Brugada (contexte de fièvre, nocturne ou iatrogénie) (1 point)
- Ayant présenté une mort subite < 45 ans sans orientation étiologique après autopsie (0,5 points)
- Le test génétique retrouvant une mutation probablement pathogène sur un gène de susceptibilité du Brugada (0,5 points)
Un score > 3,5 points pose le diagnostic, un score entre 2 et 3 le rend possible. Ce score présente surtout l'avantage d'une corrélation entre le niveau du score et le risque rythmique du patient [7], pouvant donc être utile en pratique clinique pour évaluer les options thérapeutiques.
Aspect électrocardiographique
Implications cliniques
Le fait d'être porteur d'un syndrome de Brugada est associé à un surrisque de mortalité cardiaque par troubles du rythme ventriculaire. Néanmoins, ce risque est très variable d'un individu à l'autre, y compris au sein d'une même famille et pour une même mutation. Dans la mesure où aucun traitement médicamenteux n'a encore fait ses preuves de manière significative pour prévenir le risque rythmique, l'enjeu est donc d'arriver à proposer la stratégie la plus adaptée à chaque patient en essayant de se baser sur une évaluation individualisée du risque.
L'ensemble des recommandations tenues à jour est accessible sur le site de la filière Cardiogen (https://www.filiere-cardiogen.fr/professionnel/prises-en-charge/syndrome-de-brugada/).
Recommandations générales
Il est recommandé à tous les patients porteurs d'un syndrome de Brugada d'éviter les situations et expositions pouvant majorer l'aspect électrique de Brugada et le risque rythmique [2], notamment l'hyperthermie qui devra être traitée de manière agressive et de prendre garde à la iatrogène médicamenteuse (une base de données actualisée des traitements contre-indiqués est accessible à l'URL suivante https://www.brugadadrugs.org). Il est également recommandé de limiter la consommation d'alcool, ou encore de ne pas arrêter trop brutalement un effort physique [5].
Evaluation du risque rythmique
Plusieurs auteurs se sont intéressés à mettre en évidence les facteurs pronostiques pouvant aider à la prise en charge individualisée des patients.
Depuis plus de dix ans certains facteurs ont été identifiés comme de mauvais pronostic rythmique, à commencer par l'antécédent personnel de mort subite récupérée, l'antécédent personnel de syncope et l'aspect ECG type 1 spontané [8].
Le score de Shangai, incluant un peu plus de facteurs et décrit dans les sections précédentes, s'avère également corrélé au risque rythmique de patients [7].
D'autre facteurs, comme les résultats de stimulation ventriculaire programmée, ne font pas consensus quant-à-leur bénéfice clinique et ne sont donc plus utilisés en routine clinique [5].
Options thérapeutiques
Traitement médicamenteux
Aucun traitement n'a montré d'efficacité en routine clinique pour la prévention rythmique. Bien qu'en l'absence de niveau de preuve élevé, l'hydroquinidine est parfois proposée au cas par cas [2][4], essentiellement chez les patients porteurs d'un défibrillateur présentant de chocs électriques internes à répétition.
Défibrillateur automatique implantable
L'implantation d'un défibrillateur est la méthode la plus sûre pour prévenir la mort subite. Néanmoins, son bénéfice est à mettre en balance des risque de choc inapproprié, d'infection de matériel et d'impact psycho-social chez les patients, notamment ceux chez qui le risque rythmique s'avère extrêmement faible (ie. aspect de Brugada induit par le test de provocation et absence d'antécédent personnel ou familial de mort subite/syncope).
En pratique, les recommandations HRS/EHRA/APHRS 2013 [2] et ESC 2015 [4] proposent :
- Un consensus pour équiper les patients ayant présenté une mort subite récupérée ou un épisode de tachycardie ventriculaire soutenue spontanée (Classe I).
- Une recommandation de classe IIa pour équiper les patients ayant un aspect ECG de type 1 spontané et ayant présenté une syncope (La HRS précisant que celle-ci devant être suggestive d'une origine rythmique).
- Les recommandations HRS/EHRA/APHRS 2013 [2] se prononcent en défaveur de l'implantation des patients asymptomatiques avec aspect ECG provoqué.
Pour les autres sujets, à risque intermédiaire, l'attitude vis à vis de l'implantation devrait probablement dépendre de l'évaluation des autres facteurs pronostiques (ie score de Shangai) mais aussi et surtout d'une discussion avec le patient [5].
Points Clés
- Le syndrome de Brugada est une maladie autosomique dominante à pénétrance variable. Le principal gène impliqué est SCN5a, codant pour pour la sous-unité NaV1.5 du canal sodique cardiaque INa. Néanmoins une mutation sur ce gène n'est retrouvé que dans moins de 30% des cas et les modalités d'expression de la maladie sont encore mal comprises.
- Ce syndrome se diagnostique sur l'aspect électrocardiographique spécifique dit Brugada "de type 1", qui peut être spontané ou provoqué, mais qui peut surtout être intermittent dans le temps chez un même individu.
- Le risque rythmique individuel de chaque patient est difficile à déterminer. Les situations favorisant ou majorant l'aspect électrique de Brugada doivent être évitées (fièvre, iatrogénie, alcool). Les options thérapeutiques sont pauvres et mal établies.
- La prévention de la mort subite chez les patients ayant un risque rythmique considéré élevé passe par l'implantation d'un défibrillateur.
- La liste actualisée des médicaments contre-indiqués est disponible sur ce lien : https://www.brugadadrugs.org. Auteur(s): Gaylord Ribouleau
Références
- ↑ 1. Brugada P, Brugada J. Right bundle branch block, persistent ST segment elevation and sudden cardiac death: A distinct clinical and electrocardiographic syndrome. Journal of the American College of Cardiology. nov 1992;20(6):1391‑6.
- ↑ 2,0 2,1 2,2 2,3 2,4 et 2,5 1. Priori SG, Wilde AA, Horie M, Cho Y, Behr ER, Berul C, et al. HRS/EHRA/APHRS Expert Consensus Statement on the Diagnosis and Management of Patients with Inherited Primary Arrhythmia Syndromes. Heart Rhythm. déc 2013;10(12):1932‑63.
- ↑ 1. Wilde AAM, Amin AS. Clinical Spectrum of SCN5A Mutations. JACC: Clinical Electrophysiology. mai 2018;4(5):569‑79.
- ↑ 4,0 4,1 et 4,2 1. Priori SG, Blomström-Lundqvist C, Mazzanti A, Blom N, Borggrefe M, Camm J, et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC)Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J. 1 nov 2015;36(41):2793‑867.
- ↑ 5,0 5,1 5,2 et 5,3 1. Gourraud JB, Barc J, Thollet A, Le Marec H, Probst V. Brugada syndrome: Diagnosis, risk stratification and management. Archives of Cardiovascular Diseases. mars 2017;110(3):188‑95.
- ↑ 1. Antzelevitch C, Yan GX, Ackerman MJ, Borggrefe M, Corrado D, Guo J, et al. J-Wave syndromes expert consensus conference report: Emerging concepts and gaps in knowledge. Heart Rhythm. oct 2016;13(10):e295‑324.
- ↑ 7,0 7,1 et 7,2 1. Kawada S, Morita H, Antzelevitch C, Morimoto Y, Nakagawa K, Watanabe A, et al. Shanghai Score System for Diagnosis of Brugada Syndrome. JACC: Clinical Electrophysiology. juin 2018;4(6):724‑30.
- ↑ 1. Probst V, Veltmann C, Eckardt L, Meregalli PG, Gaita F, Tan HL, et al. Long-Term Prognosis of Patients Diagnosed With Brugada Syndrome: Results From the FINGER Brugada Syndrome Registry. Circulation. 9 févr 2010;121(5):635‑43.