ECG de communication inter-atriale
Introduction
Définition
La CIA est un défect congénital de la cloison inter-auriculaire.
Epidémiologie
La CIA représente 8% des cardiopathies congénitales. Prédominance féminine (2 femmes pour 1 homme).[1]
Physiopathologie
Du fait du différentiel de pression gauche/droit, il en résulte un shunt sanguin de l’oreillette gauche vers l’oreillette droite, occasionnant en fonction de l’importance de la communication, une surcharge en volume des cavités droites, s’accompagnant d’un hyperdébit pulmonaire, pouvant à terme occasionner un remodelage microvasculaire pulmonaire et une élévation des pressions pulmonaires initialement réversible, puis fixe.
Lorsque les pressions des cavités droites dépassent celles de l’oreillette gauche, le shunt s’inverse, responsable du passage de sang désoxygéné dans la circulation systémique, et donnant lieu à l’apparition d’une cyanose. C’est le syndrome d’Eisenmenger.
Un shunt gauche-droit est considéré comme significatif si le débit pulmonaire est au moins égal à 1,5 fois le débit systémique aortique.
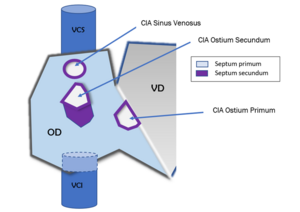
Anatomiquement on en distingue 4 types : [1]
- CIA ostium secundum (80%) située au niveau de la fosse ovale.
- CIA ostium primum (15%) située à proximité des valves atrio-ventriculaires, occasionnant un canal atrioventriculaire en cas d’association à une CIV « inlet ».
- CIA sinus venosus (5%), localisée le plus souvent à proximité de la veine cave supérieure (VCS), et parfois associée à des anomalies du retour veineux pulmonaire.
- CIA du sinus coronaire (1%), donnant lieu à une communication entre le sinus coronaire et l’oreillette gauche. Parfois associée à une VCS gauche persistante.
Diagnostic
Clinique
La symptomatologie est directement rattachée à l’importance du shunt. Dans la majorité des cas, le diagnostic est tardif car bien tolérée. Dans le cas contraire, il est possible d’observer dès l’enfance une dyspnée, des bronchites récidivantes ainsi qu’une cassure staturo-pondérale.
L’auscultation cardiaque peut révéler un dédoublement de B2, un souffle éjectionnel pulmonaire, un roulement diastolique tricuspidien, ou systolique si insuffisance tricuspidienne fonctionnelle.
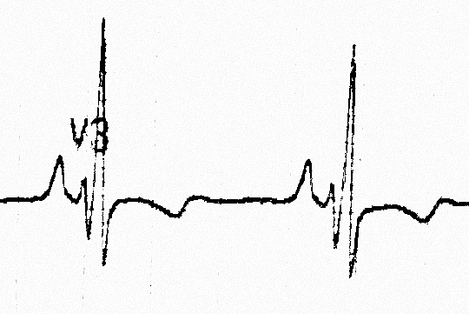
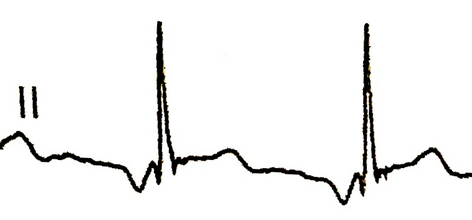
ECG
| PRESENTATION COMMUNE | ||
| Il est usuel de retrouver des signes de cœur pulmonaire chronique, à savoir un bloc incomplet droit, une HVG électrique (R’ > 6 mm en V1 (ou qR)). Les arythmies supraventriculaires sont également fréquentes. | ||
| PARTICULARITES SELON LA LOCALISATION | ||
| CIA ostium secundum | On observe une déviation axiale droite et un crochetage de l’onde R en inférieur. | |
| CIA ostium primum | On observe une déviation axiale gauche et une hypertrophie auriculaire droite. | |
| CIA sinus venosus[2] | Il est possible d’observer un rythme non sinusal (ondes P négatives en inférieur). | |
| FORMES SYNDROMIQUES | ||
| L’association à un BAV1 doit faire évoquer une mutation Nkx2.5. | ||
Echocardiographie
L’échocardiographie demeure l’examen clé. Elle permet d’évoquer le diagnostic en cas de dilatation des cavités droites, de localiser la CIA, de rechercher des anomalies associées (retour veineux pulmonaire anormal, anomalies valvulaires, HTP).
Radiographie thoracique : On observe une dilatation des cavités droites, une augmentation de la vascularisation pulmonaire avec une artère pulmonaire proéminente.
Evolution
Les petites CIA (< 5 mm) évoluent dans la majorité des cas vers une fermeture spontanée avant l’âge de 2 ans.
Quant aux CIA volumineuses :
- L’évolution est marquée par une surcharge en volume des cavités droites, occasionnant une dilatation de ces cavités, favorisant la survenue d’une insuffisance tricuspidienne fonctionnelle, d’une insuffisance cardiaque droite et d’arythmies supraventriculaitres. [3]
- L’hyperdébit pulmonaire occasionne à terme une HTAP (surtout si CIA >2 cm).
- Un shunt intermittent droit-gauche (valsalva, toux…) est susceptible d’occasionner une embolie paradoxale.
Traitement
Indications de l’intervention[1]
- CIA (quelle que soit sa localisation) isolée causant un shunt significatif symptomatique, avec dilatation des cavités droites, sans cyanose, avec PAPs < 50% de la PA systolique, et résistances vasculaires pulmonaires (RVP) < 1/3 des résistances vasculaires systémiques (RVS). (classe I, classe IIa si asymptomatique).
- CIA secundum causant un shunt significatif avec dilatation des cavités droites, sans cyanose lors d’une chirurgie cardiaque pour une autre indication. (classe IIa)
- Ne pas fermer si PAPs > 2/3 PAs ou RVP > 2/3 RVS ou shunt droit-gauche. (classe III)
Modalités de l’intervention [1]
- Fermeture percutanée si CIA secundum < 38 mm avec berges adéquates (> 5 mm des valves, de l’embouchure des veines caves, de la paroi postérieure de l’OD) et avec retour pulmonaire normal (réalisable chez l’enfant de plus de 15 kg). Impose une prévention oslérienne pendant 6 mois. [4][5]
- Fermeture chirurgicale dans les autres situations (réalisable à partir de 5 ans). Elle se fait sous CEC par sternotomie médiane ou pas thoracotomie postérolatérale.
Références
- ↑ 1,0 1,1 1,2 et 1,3 Baumgartner H, De Backer J, Babu-Narayan SV et al. 2020 ESC Guidelines for the management of adult congenital heart disease: The Task Force for the management of adult congenital heart disease of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Adult Congenital Heart Disease (ISACHD) [archive], European Heart Journal, 2021;42:563–645
- ↑ Vodusek Z, Khaliqdina S, Borz-Baba C, Scandrett R. Sinus Venosus Atrial Septal Defect: A Challenging Diagnosis. Cureus. 2019 Oct 17;11(10):e5936. doi: 10.7759/cureus.5936. PMID: 31788393; PMCID: PMC6858266.
- ↑ Loomba RS, Chandrasekar S, Sanan P, Shah PH, Arora RR. Association of atrial tachyarrhythmias with atrial septal defect, Ebstein's anomaly and Fontan patients. Expert Rev Cardiovasc Ther. 2011 Jul;9(7):887-93. doi: 10.1586/erc.11.39. PMID: 21809970.
- ↑ Klotz S, Gebhard M, Sievers HH. Late left atrial thrombosis of an Amplatzer patent foramen ovale occluder. J Thorac Cardiovasc Surg. 2011 Nov;142(5):1270-1. doi: 10.1016/j.jtcvs.2011.05.024. Epub 2011 Jul 2. PMID: 21724200.
- ↑ Turner M, Bouhout I, Petit C, et al. Transcatheter Closure of Atrial and Ventricular Septal Defects. J Am Coll Cardiol. 2022 Jun, 79 (22) 2247–2258. https://doi.org/10.1016/j.jacc.2021.08.082