Modulation neurocardiogénique
Innervation du système cardiovasculaire : systèmes parasympathique et sympathique, relais ganglionnaires cardiaques
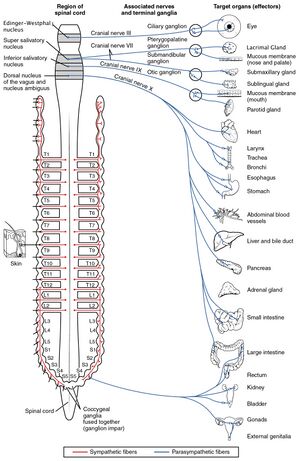
L’innervation extrinsèque du système cardiovasculaire est assurée par le système nerveux autonome, avec deux composantes antagonistes :
- Le système nerveux sympathique
- Le système nerveux parasympathique
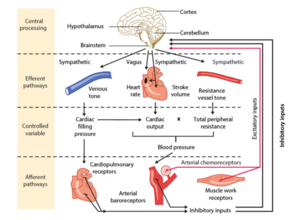
Ces deux systèmes reçoivent de multiples afférences (mécanorécepteurs, barorécepteurs, chémorécepteurs) modulant la réponse autonome cardiaque via des systèmes efférents à destination des organes cibles.
Rappels anatomiques[1][2][3]
Composante afférente du système nerveux autonome
La composante afférente du système nerveux autonome est composée d’un unique neurone sensitif. Elle transmet l’information de différents barorécepteurs, chémorécepteurs et mécanorécepteurs afin d’obtenir une réponse efférente au niveau du système cardiovasculaire. Ces différents récepteurs se situent :
- Au niveau artériel : sinus carotidien (barorécepteurs), segment horizontal de l’aorte (baro- et chémorécepteurs), artères coronaires
- Au niveau cardiaque : mécanorécepteurs au niveau des jonctions véno-atriales, des deux ventricules et du tronc de l’artère pulmonaire.
- Au niveau périphérique : au sein du muscle strié squelettique
L’ensemble des afférences autonomes gérant le tonus cardiovasculaire sont reçues au niveau du noyau solitaire, dans la partie dorsomédiale de la moelle allongée, avant de communiquer avec les différentes structures efférentes au niveau du système nerveux central :
- pour la composante efférente vagale : le noyau ambigu
- pour la composante efférente sympathique : région rostrale du bulbe ventro-latéral
Par ailleurs, de nombreuses régions du système nerveux central ont un impact sur la réponse autonome cardiovasculaire : les noyaux gris centraux (réponse d’alerte), l’hypothalamus, le cervelet et le cortex cérébral.
Composante efférente du système nerveux autonome
La composante efférente du système nerveux autonome présente une structure globale commune : un neurone préganglionnaire émergeant du tronc cérébral (portion centrale), donnant un axone vers un ganglion relais (portion intrathoracique extracardiaque) avec un motoneurone effecteur (portion cardiaque intrinsèque). Les motoneurones des systèmes sympathiques et parasympathiques exercent des effets globalement antagonistes sur les propriétés électriques et mécaniques du cœur.
La position et le trajet de ces différentes structures varient en fonction du système considéré (sympathique / parasympathique) et dans une certaine mesure à l’échelle interindividuelle[3].
Le système nerveux sympathique : émerge de la moelle épinière aux niveaux cervical, thoracique et lombaire (racines C8 à L2). Le neurone préganglionnaire fait synapse au sein de ganglions paravertébraux organisés en chaînes ganglionnaires, de part et d’autre du corps vertébral. De ce ganglion émerge un neurone post-ganglionnaire à destination de l’organe cible (neurone post-ganglionnaire long). Les ganglions sympathiques à destination du cœur émergent des racines T1 à T4.
Le système nerveux parasympathique : les neurones préganglionnaires parasympathiques émergent des différents noyaux du nerf vague (Xème paire crânienne) au niveau du tronc cérébral. Ceux-ci cheminent au sein des deux nerfs vagues, puis font synapse en périphérie de l’organe cible (neurone post-ganglionnaire court).
Au niveau cardiaque, les neurones post-ganglionnaires sympathique et préganglionnaires parasympathique se regroupent et se localisent préférentiellement dans des zones graisseuses épicardiques situées au pôle postérieur du cœur, organisés en plexi ganglionnaires[1]. Les neurones postganglionnaires sympathiques innervent le cœur soit directement, soit après avoir fait synapse au niveau de ces plexi ganglionnaires, tandis que les neurones parasympathiques font obligatoirement synapse à ce niveau. A l’innervation sympathique et parasympathique précédemment évoquée s’associent d’autres populations de neurones concourant à l’innervation autonome cardiaque.
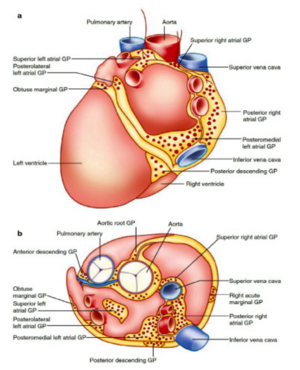
Les zones les plus richement innervées sont le nœud sinusal et le nœud atrioventriculaire, et dans une moindre mesure le tissu de conduction et le myocarde ventriculaire.
Ces plexus innervent à la fois les tissus ventriculaires et atriaux, mais il est mis en évidence que certains plexi présentent un tropisme préférentiel pour certaines structures intracardiaques :
- L’innervation du nœud sinusal est principalement retrouvée au niveau du ganglion postérieur droit ainsi qu’à l’interface entre la veine cave supérieure et l’aorte.
- L’innervation du nœud atrioventriculaire est principalement issue du ganglion postéromédial gauche, en regard de la jonction oreillette gauche – veine cave inférieure.
- Les ganglions avec un tropisme ventriculaire se localisent principalement au niveau de la racine aortique et des troncs principaux des artères coronaires.
Ce tropisme particulier de certaines régions ganglionnaires pour le fonctionnement de certaines structures intracardiaques fait de ces zones anatomiques des cibles thérapeutiques potentielles pour les pathologies cardiovasculaires médiées par le système nerveux autonome.
Effets physiologiques du système nerveux autonome sur le contrôle du rythme cardiaque normal[4]
Système sympathique
La noradénaline, neurotransmetteur émis par les neurones effecteurs du système sympathique, agit sur les récepteurs adrénergiques cardiaques, principalement de type ß1 et dans une moindre mesure ß2 et 𝞪. Une autre catécholamine systémique, l’adrénaline, sécrétée par la portion médullaire de la surrénale, présente des effets similaires.
La stimulation des récepteurs ß1 adrénergiques cardiaques entraîne ;
- Une accélération de la fréquence cardiaque : effet chronotrope positif
- Une amélioration de la conduction atrioventriculaire : effet dromotrope positif
- Un raccourcissement de la durée du potentiel d’action myocytaire
- Une augmentation de la force contractile : effet inotrope positif
- Une amélioration de la vitesse de relaxation myocardique : effet lusitrope positif
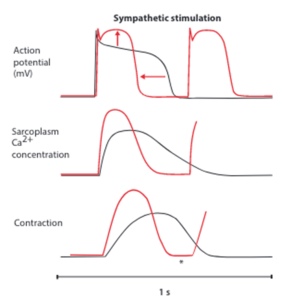
Ces modifications sont sous-tendues par différentes cascades biochimiques à l’échelle cellulaire via l’activation de la voie AMPc-PKA : stimulation des canaux If, majoration du courant entrant calcique (raccourcissement de la phase de plateau du potentiel d’action, au niveau du nœud sinusal accélération de la pente de dépolarisation spontanée), majoration du courant entrant potassique iKV (raccourcissement du temps de repolarisation).
Système parasympathique
L’acétylcholine est le neurotransmetteur émis par le neurone post ganglionnaire parasympathique. Sa cible au niveau cardiaque est le récepteur Le système parasympathique, via la sécrétion d’acétylcholine à destination des différents récepteurs muscariniques localisés dans le cœur et les vaisseaux, a une action :
- Chronotrope négative
- Inotrope négative
- Dromotrope négative
Les effets physiologiques de l’activation des récepteurs muscariniques sont sous-tendus par une inihibition de la voie AMPc-PKA, avec donc des effets antagonistes à la stimulation du système sympathique. Par ailleurs, l’hyperactivation du système parasympathique concourt à une dépression des systèmes de conduction intracardiaques et vasculaires, responsable de manifestations cliniques (lipothymie, syncope réflexe) ; on parle alors d’hypertonie vagale.
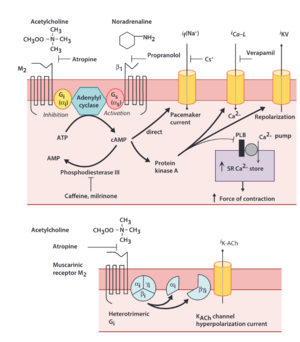
Modulation du rythme cardiaque
Les deux composantes du système nerveux autonome sont activées en permanence à divers degrés, avec une tendance prédominant du tonus vagal au repos.
La réponse cardiaque au tonus sympathique est assez lente (accélération progressive de la fréquence cardiaque relativement à l’effet inverse parasympathique) avec une atténuation progressive de son effet à l’arrêt de la stimulation : en effet la noradrénaline émise par les neurotransmetteurs est pour partie lavée par le système circulatoire, le reste étant recapturé par les neurones sympathiques. L’acétylcholine est en revanche rapidement dégradée par L’Ach estérase, entraînant une réversion rapide de son effet.
La balance adéquate de tonus sympathique et parasympathique est primordiale pour maintenir un rythme cardiaque physiologique. L’hyperactivation du système sympathique est impliquée dans l’apparition ou l’aggravation d’arythmies potentiellement fatales[5]. De même, l’hypertonie vagale est à l’origine de symptômes à type de lipothymies ou syncope[6] ; la cardioneuromodulation constitue donc un socle physiologique nécessaire à la compréhension de certaines pathologies rencontrées en cardiologie et sa connaissance ouvre la voie à des cibles thérapeutiques potentielles pour les traiter.
Références bibliographiques
- ↑ 1,0 1,1 et 1,2 Hanna P, L. Ardell J, ShivkumarKalyanam K. Cardiac Neuroanatomy for the Cardiac Electrophysiologist. J Atr Fibrillation
- ↑ Wink J, Van Delft R, Notenboom RGE, Wouters PF, DeRuiter MC, Plevier JWM, et al. Human adult cardiac autonomic innervation: Controversies in anatomical knowledge and relevance for cardiac neuromodulation. Autonomic Neuroscience. sept 2020;227:102674.
- ↑ 3,0 et 3,1 Kawashima T. The autonomic nervous system of the human heart with special reference to its origin, course, and peripheral distribution. Anat Embryol (Berl). juill 2005;209(6):425‑38.
- ↑ 4,0 4,1 4,2 et 4,3 Herring N, Paterson DJ. Levick’s Introduction to Cardiovascular Physiology, Sixth Edition.
- ↑ Ajijola OA, Lux RL, Khahera A, Kwon O, Aliotta E, Ennis DB, et al. Sympathetic modulation of electrical activation in normal and infarcted myocardium: implications for arrhythmogenesis. Am J Physiol Heart Circ Physiol. 1 mars 2017;312(3):H608‑21.
- ↑ Van Dijk JG, Van Rossum IA, Thijs RD. The pathophysiology of vasovagal syncope: Novel insights. Autonomic Neuroscience. déc 2021;236:102899.