Physiologie de la conduction intracardiaque
Conduction intracardiaque normale
L’activité électrique du cœur nait, en fonctionnement normal, dans les cellules automatiques du nœud sinusal proche de la jonction entre l’oreillette droite et la veine cave supérieure. Ces cellules spécialisées sont capables de donner spontanément naissance à un potentiel d’action (pacemaker physiologique).
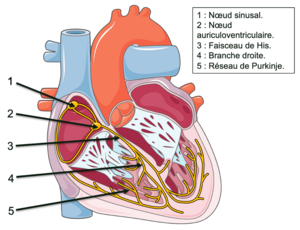
Cet influx électrique est ensuite transmis à l’ensemble du cœur par les voies de conduction intracardiaques constituées de cellules spécialisées dans la propagation de l’influx électrique. Le système de conduction électrique cardiaque est constitué du nœud sinusal, du nœud auriculo-ventriculaire, du faisceau de His, de ses branches et du réseau de Purkinje (figure 1).
Cette activation progressive est à l’origine de la dépolarisation successive des cardiomyocytes atriaux puis ventriculaires et de leur contraction suite à l’entrée massive de calcium induite.
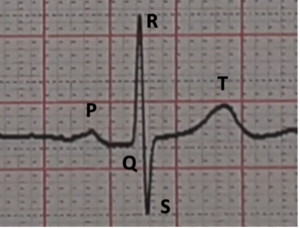
Cette activation électrique cardiaque est représentée par les différentes ondes identifiables sur l’électrocardiogramme (ECG) de surface (Figure 2) :
- Onde P : Dépolarisation atriale.
- Segment PQ : Ralentissement de l’influx électrique dans les fibres à conduction lentes de nœud auriculo-ventriculaire (NAV).
- QRS : Dépolarisation ventriculaire par les fibres rapides du réseau de His-Purkinje).
- Onde T : Repolarisation ventriculaire.
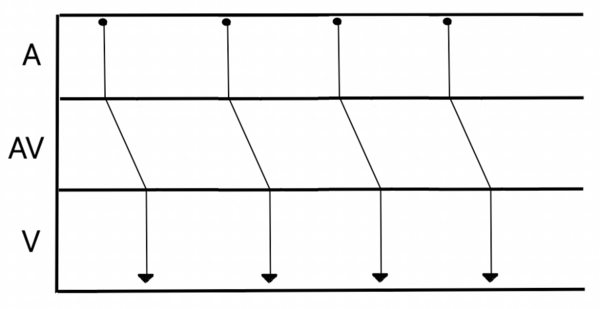
L’activation électrique cardiaque est parfois représentée sous la forme d’un dromogramme (Figure 3). Il s’agit d’une représentation schématique de la propagation de l’influx électrique à travers les voies de conduction électrique cardiaques.
La naissance de l’influx électrique est représentée par un petit cercle et les lignes représentent sa propagation dans les structures cardiaques. Une ligne est terminée par une flèche lorsque l’activation électrique est bien conduite, par un trait perpendiculaire lorsque la conduction est bloquée.
Conditions particulières de conduction intracardiaque
Conduction décrémentielle
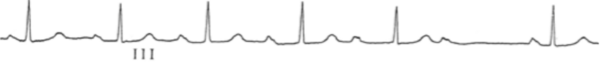
Une conduction décrémentielle est définie par une vitesse de conduction dans la structure qui diminue lorsque la fréquence de stimulation augmente (Figure 4).
Cette particularité de conduction est habituellement décrite comme spécifique du NAV mais il existe quelques exceptions, notamment certaines voies accessoires (Ex : Fibres de Mahaïm, tachycardie de Coumel).
Les capacités de conduction décrémentielle dans le NAV s’expliquent par le fait que la dépolarisation des cellules nodales en phase 0 du potentiel d’action se fait principalement par les canaux calciques voltages dépendant et non par les canaux sodiques. Cette dépolarisation est beaucoup plus lente que dans les fibres à réponse rapide, entrainant une réduction significative de la vitesse de conduction dans la région nodale.
Phénomène de Wenckebach
Allongement progressif du temps de conduction d’un influx électrique dans une portion de conduction intracardiaque jusqu’au blocage unique de cet influx, après lequel le phénomène recommence.
En effet, lorsque la fréquence augmente, les influx surviennent en période réfractaire relative du potentiel d’action précédent. Le potentiel d’action déclenché est alors de plus en plus long, responsable de ce temps de conduction de plus en plus lent. Lorsque le potentiel d’action s’allonge trop, l’influx suivant tombe en période réfractaire absolue et n’est pas conduit, autorisant la réinitialisation de ce phénomène.
Lorsque ce phénomène de Wenckebach survient au niveau du NAV, il est responsable d’un BAV 2 Mobitz 1 (Figure 5 et 6).
Aberration de conduction
L’aberration de conduction est un bloc de branche transitoire à l’occasion de variations de la fréquence cardiaque.
Le bloc en phase 3 apparaît lorsqu’un influx supraventriculaire emprunte les voies nodo-hissiennes alors que l’une des branches du faisceau de His n’est pas complètement sortie de période réfractaire (à la phase 3 du potentiel d’action). Il survient donc à l’occasion d’accélérations de la fréquence cardiaque (ESA, arythmie supraventriculaire). Il s’agit le plus souvent d’un bloc de branche droit car sa période réfractaire est souvent plus longue que la branche gauche.
Le bloc en phase 4 intervient au contraire à l’occasion de ralentissement de la fréquence cardiaque. Il est consécutif à des lésions de la branche (souvent gauche, souvent ischémique) induisant une dépolarisation partielle au repos. Après un RR long, la dépolarisation spontanée est plus importante et le potentiel membranaire est donc insuffisamment négatif. La réponse est alors lente et mal propagée, responsable de l’aspect ECG de bloc de branche.
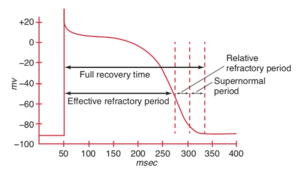
Conduction supernormale
Elle correspond à la conduction inattendue d’un influx électrique par une structure sensée se trouver en période réfractaire.
Cette conduction supranormale est possible en cas d’activation d’une cellule au cours d’une brève période de la phase 3 où l’excitation est possible en réponse à un stimulus infraliminaire (Figure 7).
Cela est rendu possible par deux facteurs : La disponibilité de canaux sodiques rapides et la proximité du potentiel seuil.
Cette conduction supranormale peut survenir à plusieurs niveaux du système de conduction :
- Au niveau du nœud AV : Amélioration inattendue de la conduction par exemple au cours d’une dissociation auriculoventriculaire ou d’un trouble du rythme supraventriculaire conduisant brutalement avec un RR court.
- Dans le faisceau de His ou une de ses branches : Disparition transitoire d’un bloc de branche par une capture en fenêtre supranormale de cette structure habituellement en période réfractaire.
Conduction cachée
Conduction d’un influx électrique dans une structure, n’induisant pas de couplage excitation-contraction mais capable d’induire une période réfractaire dans cette structure modifiant ses capacités de conduction par la suite.
Ces conductions cachées ne sont donc pas directement visualisables sur un ECG de surface mais on peut observer leurs conséquences sur les complexes suivants. Elles permettent d’expliquer un certain nombre de trouble de conduction ou du rythme.
Par exemple, une ESV dépolarisant le nœud AV par voie rétrograde mais n’étant pas capable de capturer l’oreillette n’induit pas d’onde P rétrograde. En revanche, l’onde P suivante peut être bloquée ou conduire avec un PR long du fait de cette conduction cachée dans le nœud AV alors en période réfractaire absolue ou relative (Figure 8).
Conduction rétrograde
Conduction d’un influx électrique dans le sens inverse du sens de conduction normal (classiquement des ventricules vers les oreillettes).
La conduction rétrograde n’est pas propre au NAV, elle peut emprunter le faisceau de His, ses branches ou même un faisceau accessoire.
Une activation rétrograde de l’oreillette est responsable d’une onde P rétrograde sur l’ECG, négative dans les dérivations inférieures, positive en aVR. Elle est classiquement située après une ESV, une stimulation ventriculaire, une extrasystole jonctionnelle ou même un écho en cas de dualité nodale.
Dualité nodale
Le nœud AV est constitué d’une partie centrale, composée des cellules nodales à conduction lente appelée le nœud AV compact. De ce NAV compact nait le faisceau de His qui traverse ensuite le corps fibreux central pour rejoindre le septum inter-ventriculaire.
La voie rapide emprunte ce NAV compact mais aussi un ensemble de cellules transitionnelles autour du NAV compact qui bypass beaucoup de cellules nodales.
La voie lente consiste en une extension de fibres lentes vers le bas du triangle de Koch en direction de la valve tricuspide. Elle est capable de conduire l’influx électrique vers le His en empruntant seulement des cellules nodales dont la conduction est moins rapide.
La capacité chez une même personne à conduire alternativement sur une voie rapide puis une voie lente constitue une dualité nodale.
La période réfractaire de la voie rapide est plus longue que celle de la voie lente. En fonction des vitesses de conduction et des périodes réfractaires de chaque voie (variables au cours du temps), cette dualité nodale peut autoriser des phénomènes de réentrées à l’origine des tachycardies par réentrée intranodale.
Conduction accessoire
En dehors de la conduction par le NAV, les oreillettes sont isolées électriquement des ventricules par le corps fibreux central.
Certaines anomalies embryologiques aboutissent à la persistance de communications électriques anormales entre les oreillettes et les ventricules. Ces communications anormales représentent la grande famille des voies accessoires.
En fonction de leur mécanisme de formation, elles peuvent être de différentes natures (fibres rapides ou lentes) avec différentes caractéristiques de conduction (décrémentielle ou non, antérograde, rétrograde ou les deux).
Les voies accessoires les plus fréquentes correspondent aux faisceaux de Kent, ponts musculaires atrio-ventriculaires composés de fibres à conduction rapide non décrémentielle.
D’autres voies accessoires avec des propriétés de conduction et des localisations particulières existent. Nous pouvons par exemple citer les fibres de Mahaïm ou celles impliquées dans les tachycardies de Coumel (Permanent Reentrant Jonctional Tachycardia = PJRT).
La présence d’une voie accessoire autorise des phénomènes de réentrées AV dépendantes de cette voie et du NAV (Atrio-ventricular reentrant tachycardia ou AVRT). Ces tachycardies peuvent être de 2 types :
- Orthodromiques = Empruntant les voies de conduction habituelles de manière antérograde, responsables de tachycardies jonctionnelles à QRS fins. L’influx électrique remonte à l’oreillette par la voie accessoire.
- Antidromiques = Empruntant les voies de conduction habituelles de manière rétrograde. L’influx électrique descend aux ventricules par la voie accessoire. Elles sont responsables de tachycardies jonctionnelles à QRS plus ou moins larges (selon la localisation de la voie accessoire).
- Auteur(s): Clement Quinonero