Mécanisme des arythmies
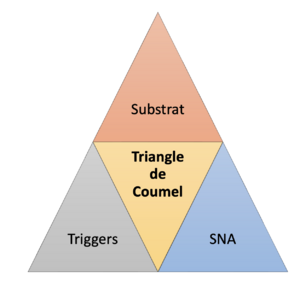
La base des mécanismes des arythmies a été décrite par Philippe Coumel qui a représenté les éléments responsables d'une arythmie sous la forme d'un triangle, où chaque sommet correspond à l'un des facteurs essentiels à la formation de l'arythmie (figure 1): le substrat électrophysiologique, les facteurs déclencheurs et les facteurs modulateurs [1]. On assimile souvent les facteurs modulateurs au système nerveux autonome, sympathique et parasympathique mais de nombreux travaux ont montré leur rôle dans la genèse de certains arythmies. Le substrat électrophysiologique est représenté par les anomalies de la conduction reposant sur le principe de rentrée et les facteurs déclenchants sont représentés principalement par les activités déclenchées comprenant les post-dépolarisations précoces et les post-dépolarisations tardives.
Figure 1 : Représentation du Triangle de Coumel : relation entre un substrat, un trigger (gâchette) et le système nerveux autonome (SNA)
Automatismes normaux et anormaux
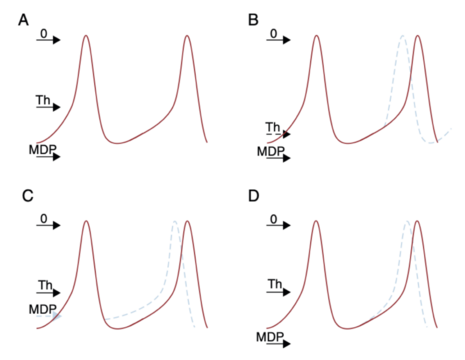
Ces entités font partie des anomalies de l'excitabilité cellulaire (figure 2). En effet des cardiomyocytes atriaux et ventriculaires ont la capacité à pouvoir de dépolariser spontanément (cf Physiologie cellulaire de l'activation électrique cardiaque). Ces automatismes peuvent être en lien avec :
- une baisse du potentiel seuil déclenchant du potentiel d'action
- dépolarisation de la membrane cellulaire au repos
- accélération de la pente de dépolarisation lente diastolique (augmentation du courant If)
Figure 2 : Représentation des automatismes normaux et anormaux d'après [2]
A. Potentiel d'action normal
B. Baisse du potentiel seuil déclenchant
C. Dépolarisation membranaire
D. Accélération de la pente de dépolarisation diastolique
Ces phénomènes se produisent lors de certaines situations cliniques notamment lors de stretch cellulaire (rencontré par exemple dans l'insuffisance cardiaque) ou d'ischémie cellulaire (infarctus du myocarde) et se manifestent par la survenue de fonctionnement anormal d'un foyer physiologique (tachycardie sinusale, Rythme idiojonctionnel accéléré (RIJA) d'extrasystoles atriales, hisiennes ou ventriculaires (His-Purkinje) mais aussi du phénomène de Rythme idioventriculaire accéléré (RIVA).
Les automatismes anormaux peuvent être supprimés par overdrive qui provoque une augmentation de la concentration sodique intracellulaire, activant la pompe Na+/K+ hyperpolarisant.
Activités déclenchées
Post dépolarisations précoces (EAD : Early After Depolarizations)
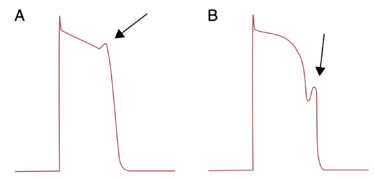
La condition nécessaire à la survenue de post-dépolarisations précoces est l'allongement du potentiel d'action cellulaire au dépend de la phase 2 et 3 du potentiel d'action (figure 3). Cet allongement du potentiel d'action peut être acquis : métabolique dans le cadre d'hypokaliémie, hypomagnésémie, iatrogène par blocage des canaux potassiques si prise d'anti-arythmiques classe III, psychotropes ou peut être congénital principalement dans le cas de syndrome du QT long congénital.
L'allongement de la durée de repolarisation permet la réactivation de canaux calciques pouvant générer un nouveau potentiel d'action, logiquement, plus le potentiel d'action est long plus il existe un nombre suffisant de canaux calciques à réactiver pour générer une nouvelle dépolarisation, les cardiomyocytes les plus propices à ce phénomène sont les cellules de Purkinje car leur potentiel d'action sont physiologiquement plus long.
La traduction clinique est la survenue de torsade de pointe, favorisée par la bradycardie et limitée par la stimulation.
Figure 3 : Post-dépolarisations précoces en phase 2 à gauche et en phase 3 à droite d'après [2]
Post dépolarisations tardives (DAD : Delayed After Depolarizations)
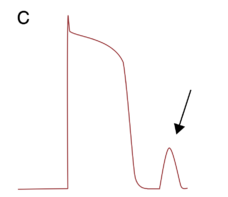
Ce phénomène est lié à la surcharge calcique intracellulaire, créant des oscillations du potentiel membranaire en phase 4 (figure 4). Ces oscillations sont liées à l'entrée d'ions sodiques via l'échangeur Na/Ca (entrée de 3 ions Na pour sortie d'un ion Ca). La surcharge calcique peut être en lien d'un trouble de la régulation cellulaire calcique congénital (comme la TV polymorphe catécholergique) ou acquises (intoxication digitalique, insuffisance cardiaque, ischémie myocardique).
La traduction clinique se manifeste par des tachycardies ventriculaires sur coeur sain ou coeur pathologique, extrasystoles ventriculaires notamment.
Figure 4 : Post-dépolarisations tardives d'après [2].
Rentrées
Le phénomène de rentrée ne participe pas au déclenchement de l'arythmie mais est le principal mécanisme du maintien de celle-ci. Ce phénomène nécessite 3 conditions indispensables :
- un bloc unidirectionnel de conduction : qui peut être secondaire des périodes réfractaires différentes du tissu proche de la zone gâchette, à un phénomène d'anisotropie (différence de vitesse de propagation de l'impulsion électrique en fonction de l'orientation longitudinale ou transversale des fibres myocardiques).
- une zone de conduction lente
- circuit d'origine anatomique (fibrose, faisceau de Kent...) ou fonctionnel.
Il existe plusieurs modèles de rentrées :
■ Rentrée avec circuit anatomique préexistant (figure 5): le plus simple et le plus fréquent avec un centre inexcitable et une fenêtre d'excitabilité. L'onde contourne alors un obstacle anatomique (crista terminalis) dans le cas du flutter commun, une zone infarcie dans le cas des tachycardies ventriculaires sur cicatrice d'infarctus générant un circuit en 8 avec au centre une zone de conduction lente, les anneaux atrio-ventriculaires dans le cas des tachycardies réciproques orthodromiques.
Figure 5 : Bloc unidirectionnel antérograde orientant l'influx vers une zone excitable (zone de conduction lente), compatibilité des périodes réfractaires permettant une remontée de l'influx et la création de la rentrée d'après [2].
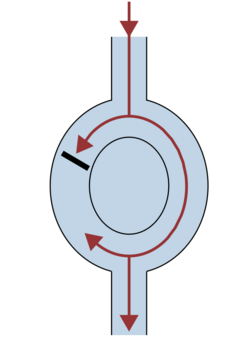
■ Rentrée fonctionnelle ou leading circle (figure 6): survient sans obstacle anatomique et sans circuit prédéterminé. Le leading circle se caractérise par la création d'un circuit autour d'un centre non excitable avec activité centripète non propagée qui a la capacité de pouvoir se déplacer. S'en approche les modèles de spirales et de rotor qui ont la propriété d'avoir un phénomène d'enroulement sur eux mêmes.
Figure 6 : représentation schématique d'un leading circle sur la gauche d'après [2]
■ Rentrée de phase 2 : se produit entre des cellules myocardiques qui ont des durées de potentiel d'action différentes (généralement entre les cellules de l'endocarde et de l'épicarde) permettant aux cellules qui ont le potentiel d'action le plus court de réactiver celles qui ont le potentiel d'action le plus long. Ce phénomène porte également le nom de dispersion de la repolarisation et est impliqué dans la fibrillation ventriculaire du syndrome de Brugada et de repolarisation précoce.
Potentiels Tardifs Ventriculaires
Définition et Méthode d'enregistrement
Les potentiels tardifs ventriculaires (PTV) représentent les dépolarisations lentes en lien avec une ou des régions pathologiques du coeur. La plupart du temps, ils ne sont pas visibles sur un électrocardiogramme (ECG) classique mais peuvent être enregistrés grâce à un ECG haute amplification. Cette méthode permet de recueillir des signaux de haute fréquence et de faible amplitude. Il s'agit d'une analyse de la sommation temporelle sur une centaine de cycles cardiaques des ventriculogrammes, points par points, pour chaque dérivation. Cette sommation permet d'amplifier la présence d'anomalies répétées, avec un filtrage particulier (25 à 40Hz pour le passe bas et 250 Hz pour le passe haut). A noter qu'il n'est pas interprétable si il existe des QRS > 120 ms, de nombreuses extrasystoles ou une tachycardie supra-ventriculaire. Son analyse est très sensible au bruit environnant ainsi toute activité électrique rapprochée, myopotentiels peuvent artéfacter le tracé et ses résultats.
On obtient à l'issue de l'examen trois valeurs [3] :
- Durée du QRS filtré : normale < 114 ms
- Voltage des 40 dernières millisecondes (Root Mean Square) RMS 40 : normale > 20 µV
- Durée de l'activité terminale du QRS dont l'amplitude est < 40 µV: normale < 38 ms
Intérêts et indications
Les PTV étaient très utilisés pour mettre en évidence la traduction électrique de la fibrose myocardique et son potentiel arythmogène, ainsi, ils ont été utilisés pour stratifier le risque rythmique dans les suites des infarctus du myocarde. Les moyens actuels sont plus efficients pour tenter de prédire le risque de mort subite, les PTV n'apportent pas suffisamment d'argument en faveur de l'implantation d'un défibrillateur dans la cardiopathie ischémique et ont donc été abandonnés dans cette cardiopathie.
En revanche, ils gardent un intérêt dans la dysplasie arythmogène du ventricule droit du fait de leur bonne spécificité (95%) et valeur prédictive positive (92%) dans le diagnostic de cette pathologie et sont donc intégrés dans le score diagnostic sous la forme d'un critère mineur [4].
Références
- ↑ Coumel Ph (1987). Coumel P, Leenhardt A. Mental activity, adrenergic modulation and cardiac arrhythmias in patients with heart disease. Circulation 1991;83:58-70
- ↑ 2,0 2,1 2,2 2,3 et 2,4 Larraitz Gaztañaga, Francis E. Marchlinski, Brian P. Betensky, Mechanisms of Cardiac Arrhythmias, Revista Española de Cardiología (English Edition), Volume 65, Issue 2, 2012, Pages 174-185,
- ↑ Nelson SD, Meier M, Mehdirad AA, Love CJ, Schaal SF. Clinical significance of an equivocal signal-averaged electrocardiogram. Am J Cardiol. 1997 Jun 1;79(11):1541-3. doi: 10.1016/s0002-9149(97)00190-2. PMID: 9185652.
- ↑ Marcus FI, McKenna WJ, Sherrill D, Basso C, Bauce B, Bluemke DA, et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed modifica- tion of the task force criteria. Eur Heart J 2010;31:806–814.