Automatisme
L’automatisme est une propriété naturelle des pacemakers physiologiques du cœur. Ainsi, les cellules du tissu nodal peuvent se dépolariser spontanément et générer un potentiel d’action qui se transmet aux cellules voisines. La fréquence des dépolarisations spontanées du nœud sinusal, du nœud AV et des cellules du réseau de His-Purkinje est voisine de 60-80, 40-60 et 20-40 battements/min. Cette fréquence dépend du potentiel de repos (fin de phase 3), de la pente de dépolarisation diastolique lente (phase 4) et du potentiel seuil. Tous ces facteurs sont modifiés par les conditions neurovégétatives, la température, le potassium, le calcium et de nombreux médicaments.[1]
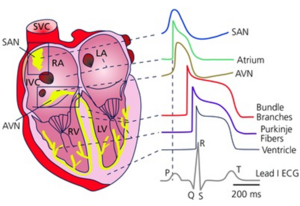
Les pacemakers physiologiques sont des groupes cellulaires doués naturellement d’automatisme et responsables de l’activation électrique du cœur. Les pacemakers principaux sont situés dans le nœud sinusal (à l’origine d’un rythme sinusal),le nœud AV, le tronc du faisceau de His (à l’origine d’un rythme jonctionnel), dans un ventricule, pacemakers accessoires fasciculaires ou ventriculaires (à l’origine d’un rythme infranodal ou rythme ventriculaire). L’activation physiologique du cœur est due au pacemaker sinusal. En cas d’automatisme défaillant (hypertonie vagale, dysfonction sinusale) ou blocage de l’influx sinusal (bloc sino-atrial), un pacemaker sous-jacent peut prendre le relais à l’origine d’un rythme d’échappement.
Il faut distinguer l’automatisme normal de l’automatisme anormal et de l’hyperautomatisme
Automatisme anormal
Certaines cellules atriales, ventriculaires ou épicardiques peuvent acquérir un automatisme anormal à l’origine d’arythmie. Les mécanismes cellulaires à l’origine d’arythmie par automatisme anormal sont nombreux, différents des arythmies liées au phénomène de réentrée. La perte de cette stabilité résulte de : 1) l’acquisition d’une dépolarisation spontanée lente en phase 4. Ce phénomène s’observe par exemple sous l’effet d’une ischémie, hypokaliémie, étirement ou anoxie : la polarisation diastolique maximale est réduite, le potentiel seuil est abaissé et/ou le potentiel de repos devient instable. Si le pacemaker physiologique naturel dominant est plus lent et ne les recycle pas avant que le potentiel seuil ne soit atteint, le foyer d’automatisme anormal génère un potentiel d’action qui se propage. 2) de variations oscillantes du potentiel de membrane en phase 3 (repolarisation) ou 4 (potentiel de repos). Ces oscillations peuvent déclencher un potentiel d’action propagé si elles atteignent le potentiel seuil (activité déclenchée). Elles sont favorisées par une fréquence cardiaque accrue, des extrasystoles, une hypertonie sympathique et/ou des catécholamines (intérêt des bêtabloquants). Un automatisme anormal est à l’origine de nombreux troubles du rythme comme une fibrillation atriale, certaines formes de tachycardie atriale focale, une parasystolie et certaines tachycardies ventriculaires (ex. TV infundibulaire, TV polymorphe catécholaminergique et torsades de pointes).[3]
Hyperautomatisme
L’Hyperautomatisme est lié à une accélération de la vitesse de dépolarisation diastolique lente (phase 4 du potentiel d’action) des cellules automatiques (atriales, jonctionnelles ou ventriculaires). Ce phénomène transitoire apparaît sous l’influence du système nerveux végétatif, de conditions métaboliques particulières (hypokaliémie, ischémie, hypoxie…) ou plus rarement d’agents pharmacologiques (ex. digitalique, isoprénaline). Il s’arrête spontanément et n’a pas de conséquence hémodynamique. C’est une cause bénigne d’arythmie qu’il faut distinguer d’un automatisme anormal ou d’une réentrée. Sur l’ECG, un hyperautomatisme se traduit par un rythme de pacemaker physiologique (cf. Rythme atrial accéléré, rythme jonctionnel accéléré ou RIJA, rythme idioventriculaire accéléré ou RIVA) dont la fréquence dépasse en général modérément celle du ou des pacemakers sus-jacents. Il est souvent entrecoupé de captures par le rythme sinusal.
Réfèrences
- ↑ https://www.e-cardiogram.com/
- ↑ Grandi E, Sanguinetti MC, Bartos DC, Bers DM, Chen-Izu Y, Chiamvimonvat N, Colecraft HM, Delisle BP, Heijman J, Navedo MF, Noskov S, Proenza C, Vandenberg JI, Yarov-Yarovoy V. Potassium channels in the heart: structure, function and regulation. J Physiol. 2017 Apr 1;595(7):2209-2228. doi: 10.1113/JP272864. Epub 2016 Nov 13. PMID: 27861921; PMCID: PMC5374109.
- ↑ Grolleau R, Gallay P. Dictionnaire des arythmies. Montpellier: Sauramps médical; 2020.
