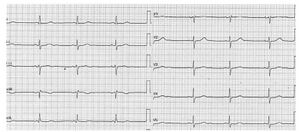
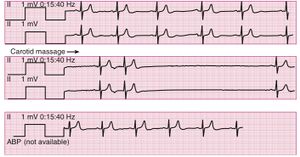
Dysfonction sinusale / bloc sino-atrial
Généralités
La dysfonction sinusale est la conséquence d’altération de l’automatisme sinusal : bradycardie ou insuffisance chronotrope ou de troubles de la conduction entre le noeud sinusal et l’oreille : bloc sino-atrial.
Anatomie et physiopathologie
Le nœud sinusal (NS) ou nœud de Keith et Flack [1] est le pacemaker du cœur. Le NS est une structure en forme de croissant de 1 à 2 cm de long et 0,5 cm de large qui se situe à la jonction entre la crista terminalis et la veine cave supérieure, en arrière de l’auricule droit. Les cellules spécialisées du NS sont entrecoupées de nerfs et de capillaires et étayées par un tissu conjonctif dense. Il est majoritairement sous-épicardique, sauf dans sa portion supérieure.
La position du pacemaker fonctionnelle se déplace dans le nœud et varie avec la stimulation sympathique et vagale, expliquant les variations de l’onde P sur l’ECG de surface.
Il est vascularisé par l’artère du nœud sinusal qui provient de la coronaire droite (ou de l’artère circonflexe en cas de réseau gauche prédominant). [2][3]
Épidémiologie
La prévalence de la dysfonction sinusale est de 1 pour 1000 personnes/an chez les adultes >45ans.
L’incidence augmente avec l’âge, de 1 pour 600 patients >65ans. [3]
Historique
Certains cas de bradycardie et d’arrêt sinusal ont été décrits depuis 1909. [4] Puis des épisodes de tachycardies alternant avec une bradycardie ont été décrits. [5]
Ca n’est que récemment que la dysfonction du nœud sinusale est décrite comme une entité à part entière. En effet, en 1960 Lown parle du « syndrome du sinus malade » (« sick sinus syndrome »). [6] Puis en 1968, Ferrer décrit la dysfonction sinusale chronique. [7]
Définition
La dysfonction sinusale, anciennement appelée maladie du sinus, est souvent due à une dégénérescence fibrotique du tissu du nœud sinusal et du myocarde adjacent. [8]
Cela peut entraîner des anomalies de la formation de l’influx électrique au niveau du nœud sinusal ou de sa propagation et donner des symptômes divers en lien avec la bradycardie.
La dysfonction sinusale est définie par une pause >3secondes et/ou une bradycardie <50bpm et des symptômes en rapport. Elle peut être distinguée du bloc de sortie sino-atrial par la présence ou non de l’influx électrique généré par le noeud sinusal.[9]
Evolution
Les études au long court suggèrent que la détérioration du NS peut être très progressive. L’étude de Shaw montre que la durée moyenne d’antécédent de bradycardie était de 14 ans. [10] Lien et al ont rapporté que la durée de la maladie chez les personnes souffrant d’un arrêt sinusal variait de 7 à 29 ans avec une moyenne de 13 ans.[11]
Etiologies
Causes organiques acquises
- Fibrose dégénérative du NS ++, principalement vers 70ans.
- Infarctus du myocarde inférieur, plus rarement latéral, par occlusion de l’artère du NS. Cette dysfonction régresse et ne doit donc pas conduire à l’implantation d’un stimulateur cardiaque.
- Post chirurgie cardiaque, aiguë (plus souvent remplacement valvulaire mitrale), régressive et ne doit donc pas conduire à l’implantation d’un stimulateur cardiaque ou tardive, jusqu’à des années après fermeture de CIA, switch atrial, dérivations cavo-pulmonaires…Nécessitant un stimulateur.
- Après greffe cardiaque.
- Hypothyroïdie, hyperthyroïdie, hypoglycémie, hypothermie, hyperkaliémie.
- Hypertension intracrânienne, phéochromocytome.
- Anorexie mentale.
- Amylose et autres maladies infiltratives.
- Sarcoïdose.
- Radiothérapie médiastinale.
- Contusion myocardique (traumatisme).
- Ablations dans l’OD.
- Tumeurs : lymphome, lipome de l’OD.
- Atteintes inflammatoires : connectivites, myocardite, péricardite.
- Atteintes infectieuses : maladie de Lyme, de Chagas, diphtérie, typhus, typhoïde, rhumatisme articulaire aigu ; il est à noter qu’une bradycardie relative = rythme plus lent que ne le voudrait la fièvre est retrouvée dans de nombreuses infections telles que la typhoïde, la listériose, la légionellose, la psittacose, le paludisme, la dengue, la leptospirose. Des anticorps dirigés contre le NS ont été décrits.
- CMH acquises ou CMH génétiques.
- Tako-Tsubo (rare).
- Maladie musculaire avec atteinte cardiaque : steinert, laminopathie ou émérinopathie, cytopathies mitochondriales, maladie de Friedreich, atrophies spinales, myasthénie ou déficit en cholinestérase.
- Cardiopathie congénitale non opérée.
- BAV congénitaux pouvant s’accompagner de dysfonction sinusale.
Causes fonctionnelles
- Hypertonie vagale : ralentissement progressif avec pauses ou bradycardie puis réaccélération dans les syncopes vaso-vagales associée à une hypotension par vosoplégie.
- Syndrome du sinus carotidien.
- Aspiration bronchique chez le patient intubé.
- Lésions médullaire au dessus de C5-C6 avec dysfonction sinusale sévère par abolition du nerf sympathique.
- Dysautonomie avec dysfonction sinusale par atteinte vago-sympathique : Parkinson, Guillain-Barré, atrophie multi-systémique, tumeurs médullaire, syringomyélie.
- SAOS, avec disparition après appareillage.
- Plongée, apnée.
- Hydrocution.
- Activité sportive intense, principalement d’endurance, par hypertonie vagale, avec accélération normale de la fréquence cardiaque à l’effort et absence de symptômes.
Causes médicamenteuses
°Anti-arythmiques :
- Classe I : flécaine, propafénone, cibenzoline, disopyramide, hydroquinidine, lidocaïne
- Béta-bloquants, surtout si dépourvus d’activité sympathomimétique intrinsèque
- Inhibiteur calcique bradycardisant : vérapamil et diltiazem
- Classe 3 : sotalol et amiodarone
- Adénosine
- Ivabradine
- Digoxine
- Antiarythmiques multi-canaux : ibutilide, dronadérone
°Anti-hypertenseurs sympatholytiques :
- Alpha-méthyl dopa
- Clonidine
- Réserpine
- Rilménidine
°Psychotropes :
- Lithium
- Neuroleptiques : phénothiazines, risperidone, amisulpride, quiétapine
°Toxiques :
- Cannabis, opiacés, cocaïne
- Organo-phosphorés
- Toluène
°Agents anti-infectieux :
- Quinine, hydroxychloroquine
- Liponavir-ritonavir
- Tigecycline
- Amphotéricine B
°Anti-épileptiques et traitements à visées neurologiques
- Cisplatine
- Interféron
- Immuno-thérapie (anti-PD1 : pembrolizumab)
- Anthracyclines : idarubicine, mitoxantrone, doxorubicine, fludarabine, cytarabine
°Autres :
- Ticagrelor
- Cimétidine, ranitidine
°Anesthésiques généraux ou rachis-anesthésie
- Dexmedetomidine, fentanyl, remifentanyl, propofol. L’anesthésie elle-même peut induire des déséquilibres vago-sympathiques avec bradycardie passagère.
- Curares : vecuronium, suxamethonium
Causes génétiques
- Gènes impliqué dans l’électrophysiologie sinusale (HCN4, SCN5A) de transmission autosomique dominante, souvent associé à de la FA.
- Perte de fonction des canaux CaV1.3.
- Bradycardie sinusale fréquente dans les syndromes du QT long.
- Mutations Ryr2 des TV cathécolergiques avec bradycardie sinusale.
- Mutations sur les gènes de la myosine responsables de CMH.
- Dysfonction sinusale parfois retrouvée dans le syndrome de Brugada (souvent associée à des arythmies atriales)
ECG
Bradycardie sinusale (<60bpm, majeure <40bpm)
avec parfois échappement jonctionnel et dissociation isorythmique.
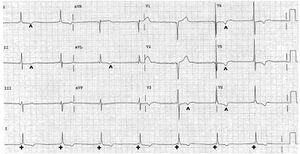
Pause sinusale
à différencier d’une ESA bloquée ou d’un à coup vagal. Il faut bien regarder l’onde T !

Bloc sino-atrial (BSA) :
° BSA du 1er degré : allongement du temps de conduction entre le NS et l’oreillette, que l’on ne peut donc pas voir sur un ECG de surface. Seule l’exploration électrophysiologique permet de faire le diagnostique. On peut cependant le suspecter par une pause après une extra-systole prolongée.
° BSA du 2ème degré : pause liée à l’absence d’une ou plusieurs ondes p, dont on distingue deux sous-types :
* BSA 2 type 1 : pauses répétées, précédées d’une accélération discrète (voire un ralentissement), en rapport avec une conduction décrémentielle entre le NS et les oreillettes, qui s’apparente à un phénomène de Wenckebach pour le NAV, avec diminution (voire augmentation) de l’incrément avec la pause. Ainsi, la pause est inférieure à deux fois le cycle le plus court de la séquence.
* BSA 2 type 2 : absence d’une ou plusieurs ondes p avec la durée de la pause qui est un multiple exacte du cycle du rythme sinusal.
Le diagnostique différentiel est une extra-systole atriale bloquée.

BSA du 3ème degré :
absence d’ondes p, avec rythme d’échappement jonctionnel (au niveau de la partie basse du nœud d’Ashoff-Tawara ou de la portion adjacente du tronc commun du faisceau de His dite région nodo-hisienne), qui peut être suivi d’une onde P sinusale, qui est alors soit bloquée, soit conduite au ventricule. Si aucun foyer jonctionnel n’apparait, un foyer ventriculaire (plus bas situé, QRS large) ou occasionnellement un autre foyer atrial lent (le plus souvent un foyer du sinus coronaire, acticité atriale négative dans les dérivations inférieures) peuvent faire office de pacemaker subsidiaire. Quand l’échappement est jonctionnel, l’aspect du complexe QRS n’est habituellement pas modifié par rapport à celui observé lorsque le rythme est sinusal.


Arrêt sinusal :
Pause brutale et prolongée qui ne correspond pas à un multiple du cycle de base, par baisse de l’automatisme sinusal avec une incapacité du nœud sinusal d’engendrer une ou plusieurs impulsions. Il s’agit d’une anomalie de conduction de l’influx qui naît normalement dans le nœud sinusal mais n’est pas transmis aux cellules myocardiques auriculaires adjacentes (maladie péri-sinusale avec bloc de sortie permanent ou intermittent).
Lorsque la pause est prolongée, on parle d’asystolie.
La pause peut être secondaire à une hypertonie vagale et il convient de rechercher systématiquement un facteur déclenchant.
- Une forme particulière est la maladie rythmique de l’oreillette (syndrome brady-tachycardie) avec alternance de dysfonction sinusale et fibrillation atriale.
- Des pauses peuvent survenir lors d’une réduction d’une d’arythmie supraventriculaire.

Orientation diagnostique
Dans un premier temps, il faut rechercher une cause physiologique ou réversible et la traiter le cas échéant.
En cas de suspicion de cardiopathie, une échographie peut-être réalisée (grade IIa), voire une imagerie en coupe ou d’autres types d’imageries (ETO, PET-TDM) si l’on a des arguments pour une cause particulière (infiltrative, endocardite, cardiopathie congénitale, etc).
Si le patient n’a pas de symptômes, une surveillance est préconisée, dans le cas inverse, un Holter ECG sera réalisé ou une épreuve d’effort en cas de symptômes en lien avec l’effort.

Prise en charge
Selon les recommandations de l’ESC de 2021[13], une stimulation permanente est indiquée en cas de symptômes clairement attribuables à la bradycardie, avec mise en place des algorithmes permettant d’éviter une stimulation VD délétère (variables selon les constructeurs). L’asservissement sera programmé en cas d’insuffisance chronotrope avec symptômes à l’effort.
Une ablation de tachycardie supra-ventriculaire, (la plupart du temps de la FA), peut-être proposée dans deux circonstances : en cas de syndrome brady-tachycardie, (permettant de stopper le traitement bradycardisant) ou en cas de pauses post réductionnelles.
Une stimulation permanente peut-être envisagée chez les patients explorés pour syncope chez qui des pause(s) asymptomatique(s) de plus de 6 secondes dues à un arrêt sinusal sont finalement documentées.
Une stimulation peut-être considérée si les symptômes sont possiblement en lien avec une bradycardie.
Enfin, en cas de causes réversibles ou en l’absence de symptômes, la stimulation n’est pas recommandée.

Références
- ↑ Keith A, Flack M. The form and nature of the muscular connections between the primary divisions of the vertebrate heart. J Anat Physiol 1907; 41:172– 189.
- ↑ Boyett MR, Honjo H, Kodama I. The sinoatrial node, a heterogeneous pacemaker structure. Cardiovasc Res. 2000;47:658–87.
- ↑ 3,0 et 3,1 Roy MJ, Kumar S. Sinus node and Atrial Arrhythmias. Circulation. 2016; 133:1892-1900.
- ↑ Laslett EE. Syncopal attacks, associated with prolonged arrest of the whole heart. Q J Med 1909; 2: 347-49.
- ↑ Birchfield RI, Menefee EE, Bryant GDN. Disease ofthe sino-atrial node, associated with bradycardia, asystole, syncope and paroxysmal atrial fibrillation. Circulation 1957; 16: 20-26.
- ↑ Lown B. Electricalreversionof cardiac arrhythmias. Br Heart J 1967; 469-89.
- ↑ Ferrer MI. The sick sinus syndrome in atrial disease. J Am Med Assoc 1968; 206: 645-46.
- ↑ 8,0 et 8,1 Kusumoto M, Schoenfeld H, et al. 2018 ACC/AHA/HRS Guideline on the Evaluation and Management of Patients With Bradycardia and Cardiac Conduction Delay. JACC. Vol 74. 2019; 51-156.
- ↑ D.B. Shaw, D.P. Southall, Sinus node arrest and sino-atrial block, European Heart Journal. 1984; 83-87.
- ↑ Shaw DB, Kekwick CA. Potential candidates for pacemakers. Survey of heart block and sinoatrial disorder (sick sinus syndrome). Br Heart J 1978; 40: 99-105.
- ↑ Lien WP, Lee YS, Chang FZ, Lee SY, Chen CM, Tsai HC. The sick sinus syndrome; natural history of dysfunction of the sino-atrial node. Chest 1977; 72: 628-34.
- ↑ Podrid J. ECG Response: August 6, 2013. Isorhythmic dissociation. Circulation. 2013 Aug 6;128(6):673.
- ↑ 13,0 et 13,1 Glikson M, Nielsen JC, Kronborg MB, et al. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. European Heart Journal. 2021; 00, 1-94.